
Enzim Nedir?
Enzimler biyolojik katalizörlerdir. Aktivasyon enerjisini düşürerek tepkimeyi hızlandırır ve tersinir olduklarından tekrar tekrar kullanılabilirler.
Enzimlerin Genel Özellikleri Nelerdir?
- Biyolojik katalizörlerdir.
- Reaksiyonu başlatmak için koenzime ihtiyaç duyarlar.
- Substratın yüzey artışı enzimin etkinliğini arttırır.
- Reaksiyonu hızlandırır veya yavaşlatırlar.
- Tersinirdirler.
- Protein yapılıdırlar.
- Yüksek sıcaklıkta bozulurlar
- Aktivasyon enerjisini düşürürler.
- Yan ürün oluşturmazlar.
- Metabolik yolları düzenlerler.
Koenzim Ve Kofaktör Nedir?
- Koenzim: Enzimin vitamin ve türevlerinden oluşan kısmıdır.
- Kofaktör: Enzimin metal iyonlarından oluşan kısmıdır.
Apoenzim, Holoenzim Ve Zimojen Enzim Nedir?
- Apoenzim: Aktif bölgenin dışında kalan protein kısmıdır.
- Holoenzim: Apoenzim ve koenzimin birleşmiş halidir.
- Zimojen Enzim: Enzimin inaktif halidir.
Prostatik Grup Nedir?
Enzimin yapısında bulunup, ayrılmayan kısımdır. Koenzim çeşididir.
Enzim Spesifikliği Nedir?
- Mutlak Spesifiklik
- Grup Spesifikliği
- Stero Spesifiklik
- Bağ Spesifikliği
Katalizör Nedir?
Katalizörler, aktivasyon enerjisini düşüren ve tepkimeyi hızlandıran maddelerdir. Katalizörler 2’ye ayrılır.
1.) Biyolojik Katalizör
Hedefe odaklıdır, spesifiktir. %100 verimle çalışır. Yan ürün oluşturmaz.
2.) Kimyasal Katalizör
Her taraftan kesim yapabilir, spesifik değildir. %100 verimle çalışmaz ve yan ürün oluşturabilir.
Enzimlerin Reaksiyonu
Ünite Ve Spesifik Aktivite Nedir?
- Ünite: 1 µmol supstratı 1 dakikada ve optimal koşullarda ürüne çeviren enzim miktarıdır.
- Spesifik Aktivite: Ünite/substrat miktarı
Reaksiyon Hızını Etkileyen Faktörler Nelerdir?
- Ph
- Sıcaklık
- Enzim Konsantrasyonu
- Zaman
- Işık vs.
NoT: Enzim konsantrasyonu sabit tutulduğunda, substrat sürekli arttırılırsa reaksiyon hızı önce artar, daha sonra sabit bir şekilde devam eder. Bu enzim substrat grafiğine ise Michaelis-Menten grafiği denir.
KM Değeri Ve Vmax Nedir?
KM: Enzimin substrata ilgisidir.
Vmax: Enzimin reaksiyonu gerçekleştirdiği maksimum hızdır.
Not: Enzimlerin genel olarak en iyi çalıştığı Ph 5-8 arasıdır.
Ph Değişimi Enzim Aktivitesini Nasıl Etkiler?
Enzimin aktif bölgesi protein yapılıdır. Proteinler aminoasitlerden oluşur. Aminoasitlerin radikal grubunda iyonlaşma gösterebilecek radikal var ise Ph ortamındaki hidrojen, bu radikali iyonlaştırarak enzimin yapısını bozabilir. Dolayısı ile enzimin konformasyonu değişeceğinden artık substratına etki edemez hale gelir.
İnhibitör Ve Aktivatör Nedir?
- İnhibitör: Enzimin aktivitesini durduran etmendir. İyon olabilir.
- Aktivatör: Enzimin aktivitesini arttıran etmendir.
İnhibisyon Çeşitleri Nelerdir?
- Yarışmalı İnhibisyon (Tersinir): Enzim substratı ile yarışır. Enzim substratına benziyordur. Substrat miktarı arttırılarak bu durum ortadan kaldırılabilir.
- Yarışmasız İnhibisyon (Tersinmez): Geri dönüşümsüzdür. Enzim miktarını arttırmak etki yapmaz.
- Yarı Yarışmalı İnhibisyon
Allosterik Enzim Nedir?
Reaksiyona dışarıdan müdahale edilmesidir. Aktif bölgenin dışında bir yere bağlanıp yönlendirme yapar.
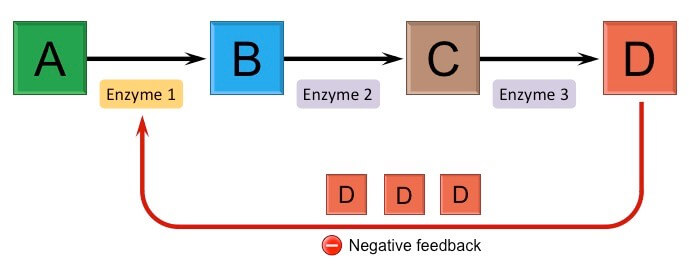
Feedback İnhibisyonu Nedir?
A enziminin K substratından L ürününü ve B enziminin Lsubstratından M ürününü ürettiği bir reaksiyon düşünün. Ortamda çok fazla M ürünü biriktiğinde, M ürünü A’ya uyarı vererek reaksiyonu durdurmasını bildirir. Böylece ortamda çok fazla M’nin üretilmesi ve gereksiz yere K substratının harcanması önlenmiş olur.
Kovalent Modifikasyon Nedir?
Enzime bir grubun bağlanması ile aktivitesinin değişmesidir.
NoT: Fosfat bağlayan enzimlere kinaz, fosfat kopartan enzimlere fosfataz denir.
NoT: Glikojen sentezinden glikojen sentetaz, glikojen yıkımından glikojen fosforilaz sorumludur. Bu enzimlere fosfat bağlayanlar kinazlardır. Fosfat bağlandığında sentetaz aktifken inaktif, fosfataz inaktifken aktif olur. Bu olay kovalent modifikasyona iyi bir örnektir.
Enzim aktivitesi ölçülürken; kaybolan substrata veya oluşan ürüne bakılır.
Enzim Aktivitesi
Enzim Aktivitesi Ölçüm Tipleri Nelerdir?
- İlk Hız Deneyi: Kısa sürer. Analizi ve yapılması kolay bir yöntemdir.
- İlerleme Eğrisi: Hem enzim hem de oluşan ürün ölçülür. Uzun zaman gerektirdiğinden pek tercih edilmez.
- Geçici Kinetik Deneyi: İlk sıçrama anında inceleme yapılır. Hızlı olduğundan takibi zordur. Pek kullanılmaz.
- Relaksiyon Deneyleri: Ortama eklenen maddeye göre tepkiye bakılır.
Enzim Aktivitesi Ölçüm Yöntemleri Nelerdir?
- Spektrofotometrik: En fazla kullanılan yöntemdir. Uygun dalga boyunda gönderilen ışığın absorbans değerine bakılır.
- Florometrik
- Kalorimetrik
- Kemilüminesans
- Işık Saçılımı
- Monometrik
- Polorimetrik
- Kimyasal Tayin Yöntemi
- Radyometrik
- Kromotografik
NoT: Enzimlerin mikroorganizmalarda üretilmesinin sebebi, kolay çoğalabiliyor olmalarıdır.
Enzim Üretimi İçin Seçilen Organizma
- Kolay çoğalmalı
- Ucuz olmalı
- Toksik olmamalı
- Yan ürün üretmemeli
- Zamandan tasarruf sağlamalı
- Yüksek verimli olmalı
İmmonilize Nedir?
İmmobilizasyon; suda çözünen bir enzimi, suda çözünmez hale getirme işlemidir. Tekrar tekrar kullanılabilir. Yapısı dağılmadan bozulmaz. 4 şekilde immobilizasyon yapılabilir.
- Kovalent Bağlama
- Çapraz Bağlama
- Kafes
- Kapsül
Enzim Kinetiği Nedir?
Enzim tarafından katalizlenen reaksiyonların hızının ifadesidir.

Enzimler hakkında birçok bilgi öğrendim. Ödevimde çok yardımcı oldunuz, teşekkürler.